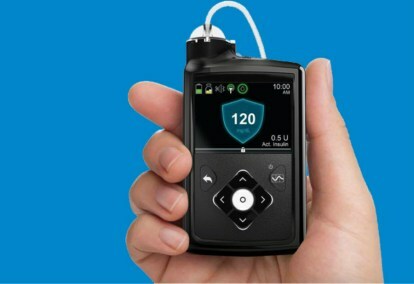
Sistem Medtronic MiniMed 670G je nosljiva naprava, ki združuje stalno spremljanje glukoze v krvi – testiranje krvnega sladkorja – z insulinsko črpalko. Algoritem, uporabljen za prilagoditev odmerjanja insulina, imenovan SmartGuard HCL, je bil zadnji korak v Medtronicovem postopnem razvoju sistema z zaprto zanko.
Priporočeni videoposnetki
Po mnenju Richarda M. Bergenstal, M.D., glavni raziskovalec študije in izvršni direktor mednarodnega centra za sladkorno bolezen Park Nicollet v Minneapolisu, »Podatki iz osrednjega preskušanja so bili prepričljivi in prepričan sem, da bodo to terapijo dobro sprejeli tako klinični kot bolniki. skupnost."
Tudi JDRF je navdušen. »Ta pomemben mejnik predstavlja pomemben korak naprej pri obvladovanju sladkorne bolezni tipa 1 in bo izboljšati kakovost življenja tistih, ki živijo s to kronično boleznijo,« je dejal Derek Rapp, predsednik JDRF in DIREKTOR. »Zelo smo opogumljeni zaradi hitrosti, s katero je FDA odobrila to prelomno tehnologijo, in ponosni smo na vlogo JDRF pri doseganju tega razburljivega preboja. Medtronic in JDRF sta zavezana zagotavljanju ustreznega dostopa bolnikov do te terapije.«
Sistem MiniMed 670G vključuje merilnik glukoze Guardian Sensor podjetja Medtronic, ki ima sedemdnevno življenjsko dobo baterije. Guardian poleg spremljanja ravni glukoze tudi sammonitorji senzor — če se pacienti zanašajo na senzor, je lahko vsaka okvara usodna, zato je samodiagnostika ključnega pomena. To je prvi in doslej edini senzor, ki ga je odobrila FDA za sisteme z zaprto zanko. Algoritem SmartGuard HCL se lahko nauči, koliko insulina potrebuje bolnik, da zagotovi, da ravni glukoze ostanejo znotraj optimalnega ciljnega območja. Edina dejanja, ki jih zahtevajo bolniki, so vnos vnosa ogljikovih hidratov ob obroku in občasno umerjanje senzorja. Nič več večkratnih prijemov s prsti, meritev in samoinjiciranja insulina.
Komercialna izdaja in razpoložljivost MiniMed 670G se pričakujeta spomladi 2017, regulativna odobritev v drugih državah pa se pričakuje to poletje.
Priporočila urednikov
- FDA odobri prvo aplikacijo za pametne telefone za dovajanje insulina
Nadgradite svoj življenjski slogDigitalni trendi bralcem pomagajo slediti hitremu svetu tehnologije z vsemi najnovejšimi novicami, zabavnimi ocenami izdelkov, pronicljivimi uvodniki in enkratnimi vpogledi v vsebine.




