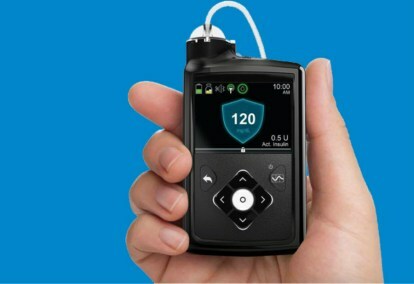
Medtronic MiniMed 670G-systemet är en bärbar enhet som kombinerar kontinuerlig blodsockerövervakning - blodsockertestning - med en insulinpump. Algoritmen som användes för att justera insulindoseringen, kallad SmartGuard HCL, var det sista steget i Medtronics stegvisa utveckling av det slutna systemet.
Rekommenderade videor
Enligt Richard M. Bergenstal, M.D., huvudutredare för studien och verkställande direktör för Park Nicollet International Diabetes Center i Minneapolis, "Data från den pivotala studien var övertygande och jag är övertygad om att denna terapi kommer att tas emot väl av både den kliniska och patienten gemenskap."
JDRF är också entusiastisk. "Denna betydelsefulla milstolpe representerar ett viktigt steg framåt i hanteringen av typ 1-diabetes och vilja förbättra livskvaliteten för dem som lever med denna kroniska sjukdom, säger Derek Rapp, JDRFs president och VD. "Vi är mycket uppmuntrade av den hastighet med vilken denna banbrytande teknologi godkändes av FDA, och vi är stolta över den roll JDRF spelade för att uppnå detta spännande genombrott. Medtronic och JDRF har åtagit sig att säkerställa lämplig patienttillgång till denna terapi."
MiniMed 670G-systemet inkluderar Medtronics glukosmätare Guardian Sensor, som har en batteritid på sju dagar. Förutom att övervaka glukosnivåer, har The Guardian också själv-övervakar sensorn — om patienter litar på sensorn kan alla haverier vara dödliga, så självdiagnostik är avgörande. Detta är den första och hittills enda sensor som godkänts av FDA för slutna system. SmartGuard HCL-algoritmen har förmågan att lära sig patientens insulinbehov för att vara säker på att glukosnivåerna håller sig inom det optimala målintervallet. De enda åtgärder som patienterna kräver är att mata in kolhydratintag vid måltiden och regelbundet kalibrera sensorn. Inga fler fingerstick, mätningar och självadministrerade insulinsprutor.
Kommersiell release och tillgänglighet av MiniMed 670G förväntas under våren 2017 och myndighetsgodkännande i andra länder förväntas den sommaren.
Redaktörens rekommendationer
- FDA rensar den första smartphone-appen någonsin för insulintillförsel
Uppgradera din livsstilDigitala trender hjälper läsare att hålla koll på den snabba teknikvärlden med alla de senaste nyheterna, roliga produktrecensioner, insiktsfulla redaktioner och unika smygtittar.




