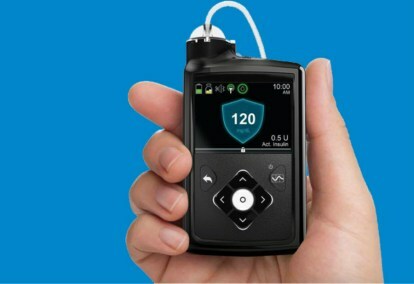
Медтрониц МиниМед 670Г систем је носиви уређај који комбинује континуирано праћење глукозе у крви — тестирање шећера у крви — са инсулинском пумпом. Алгоритам који се користи за подешавање дозирања инсулина, назван СмартГуард ХЦЛ, био је последњи корак у фазном развоју Медтроницовог система затворене петље.
Препоручени видео снимци
Према Ричарду М. Бергенстал, МД, главни истраживач студије и извршни директор Парк Ницоллет међународног центра за дијабетес у Минеаполису, „Подаци из кључног испитивања су били убедљиви и уверен сам да ће ова терапија бити добро прихваћена и од стране клиничких и пацијената. заједница.”
ЈДРФ је такође одушевљен. „Ова значајна прекретница представља важан корак напред у управљању дијабетесом типа 1 и воља побољшати квалитет живота за оне који живе са овом хроничном болешћу“, рекао је Дерек Рапп, председник ЈДРФ и ДИРЕКТОР. „Веома смо охрабрени брзином којом је ФДА одобрила ову револуционарну технологију и поносни смо на улогу коју је ЈДРФ одиграо у постизању овог узбудљивог открића. Медтрониц и ЈДРФ су посвећени обезбеђивању одговарајућег приступа пацијентима овој терапији.”
Систем МиниМед 670Г укључује Медтрониц-ов Гуардиан Сенсор монитор глукозе, који има век трајања батерије од седам дана. Поред праћења нивоа глукозе, Гуардиан такође само-монитори сензор — ако се пацијенти ослањају на сензор, сваки квар може бити фаталан, тако да је самодијагностика од виталног значаја. Ово је први и до сада једини сензор који је одобрила ФДА за системе затворене петље. СмартГуард ХЦЛ алгоритам има могућност да научи пацијентов инсулин који треба да буде сигуран да ниво глукозе остане у оптималном циљном опсегу. Једине радње које захтевају пацијенти су да уносе унос угљених хидрата током оброка и периодично калибришу сензор. Нема више вишеструких штапића прстију, мерења и инсулинских ињекција које се сами дају.
Комерцијално објављивање и доступност МиниМед 670Г се очекује у пролеће 2017. године, а регулаторно одобрење у другим земљама се очекује тог лета.
Препоруке уредника
- ФДА уклања прву апликацију за паметне телефоне за испоруку инсулина
Надоградите свој животни стилДигитални трендови помажу читаоцима да прате убрзани свет технологије са свим најновијим вестима, забавним рецензијама производа, проницљивим уводницима и јединственим кратким прегледима.




