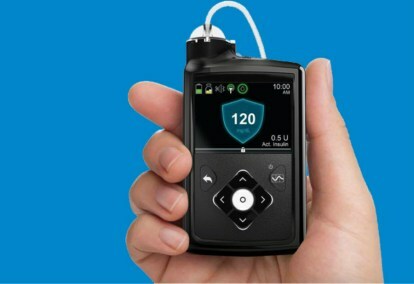
Medtronic MiniMed 670G-systemet er en bærbar enhet som kombinerer kontinuerlig blodsukkermåling – blodsukkertesting – med en insulinpumpe. Algoritmen som ble brukt til å justere insulindoseringen, kalt SmartGuard HCL, var det siste trinnet i Medtronics trinnvise utvikling av lukket sløyfe-systemet.
Anbefalte videoer
I følge Richard M. Bergenstal, M.D., hovedetterforsker av studien og administrerende direktør for Park Nicollet International Diabetes Center i Minneapolis, "Dataene fra den sentrale studien var overbevisende, og jeg er sikker på at denne behandlingen vil bli godt mottatt av både den kliniske og pasienten samfunnet."
JDRF er også entusiastisk. "Denne betydningsfulle milepælen representerer et viktig skritt fremover i behandlingen av type 1 diabetes og vilje forbedre livskvaliteten for de som lever med denne kroniske sykdommen," sa Derek Rapp, JDRF-president og ADMINISTRERENDE DIREKTØR. "Vi er veldig oppmuntret over hastigheten som denne banebrytende teknologien ble godkjent av FDA, og vi er stolte over rollen JDRF spilte i å oppnå dette spennende gjennombruddet. Medtronic og JDRF er forpliktet til å sikre passende pasienttilgang til denne behandlingen."
MiniMed 670G-systemet inkluderer Medtronics Guardian Sensor-glukosemonitor, som har syv dagers batterilevetid. I tillegg til å overvåke glukosenivåer, har The Guardian også selv-monitorer sensoren – hvis pasienter stoler på sensoren, kan ethvert sammenbrudd være dødelig, så selvdiagnostikk er avgjørende. Dette er den første og så langt eneste sensoren godkjent av FDA for lukkede sløyfesystemer. SmartGuard HCL-algoritmen har evnen til å lære pasientens insulinbehov for å være sikker på at glukosenivåene holder seg innenfor det optimale målområdet. De eneste handlingene som kreves av pasienter er å legge inn karbohydratinntak ved måltid og periodisk kalibrere sensoren. Ikke flere fingerstikker, målinger og selvadministrerte insulinsprøyter.
Kommersiell utgivelse og tilgjengelighet av MiniMed 670G forventes våren 2017 og regulatorisk godkjenning i andre land forventes den sommeren.
Redaktørenes anbefalinger
- FDA klarerer den første smarttelefonappen noensinne for insulinlevering
Oppgrader livsstilen dinDigitale trender hjelper leserne å følge med på den fartsfylte teknologiverdenen med alle de siste nyhetene, morsomme produktanmeldelser, innsiktsfulle redaksjoner og unike sniktitter.




