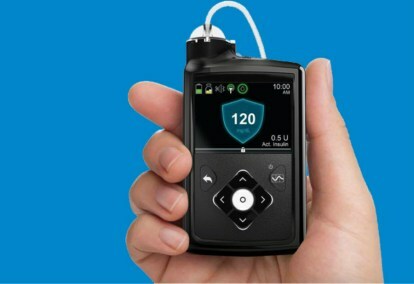
Het Medtronic MiniMed 670G-systeem is een draagbaar apparaat dat continue bloedglucosemonitoring (bloedsuikertesten) combineert met een insulinepomp. Het algoritme dat wordt gebruikt om de insulinedosering aan te passen, genaamd SmartGuard HCL, was de laatste stap in de gefaseerde ontwikkeling van het gesloten-lussysteem door Medtronic.
Aanbevolen video's
Volgens Richard M. Bergenstal, M.D., hoofdonderzoeker van het onderzoek en uitvoerend directeur van het Park Nicollet International Diabetes Center in Minneapolis, “De gegevens uit het centrale onderzoek waren overtuigend en ik heb er vertrouwen in dat deze therapie goed ontvangen zal worden door zowel de klinische als de patiënt. gemeenschap."
Ook de JDRF is enthousiast. “Deze belangrijke mijlpaal vertegenwoordigt een belangrijke stap voorwaarts in de behandeling van diabetes type 1 de levenskwaliteit verbeteren van mensen die met deze chronische ziekte leven”, zegt Derek Rapp, president van JDRF en DIRECTEUR. “We zijn zeer bemoedigd door de snelheid waarmee deze baanbrekende technologie werd goedgekeurd door de FDA, en we zijn trots op de rol die JDRF heeft gespeeld bij het bereiken van deze opwindende doorbraak. Medtronic en JDRF doen er alles aan om de juiste toegang van patiënten tot deze therapie te garanderen.”
Het MiniMed 670G-systeem bevat de Guardian Sensor-glucosemonitor van Medtronic, die een batterijduur van zeven dagen heeft. Naast het monitoren van de glucosewaarden, controleert de Guardian ook zelfmonitoren de sensor – als patiënten op de sensor vertrouwen, kan elke storing fataal zijn, dus zelfdiagnostiek is van cruciaal belang. Dit is de eerste en tot nu toe enige sensor die door de FDA is goedgekeurd voor gesloten-lussystemen. Het SmartGuard HCL-algoritme heeft de mogelijkheid om de insulinebehoeften van de patiënt te leren kennen om er zeker van te zijn dat de glucosespiegels binnen het optimale doelbereik blijven. De enige acties die patiënten nodig hebben, zijn het invoeren van de koolhydraatinname tijdens de maaltijd en het periodiek kalibreren van de sensor. Geen meerdere vingerprikken, metingen en zelf toegediende insuline-injecties meer.
De commerciële release en beschikbaarheid van de MiniMed 670G worden verwacht in het voorjaar van 2017 en goedkeuring door de regelgevende instanties in andere landen wordt die zomer verwacht.
Aanbevelingen van de redactie
- FDA keurt allereerste smartphone-app goed voor insulinetoediening
Upgrade uw levensstijlMet Digital Trends kunnen lezers de snelle technische wereld in de gaten houden met het laatste nieuws, leuke productrecensies, inzichtelijke redactionele artikelen en unieke sneak peeks.



