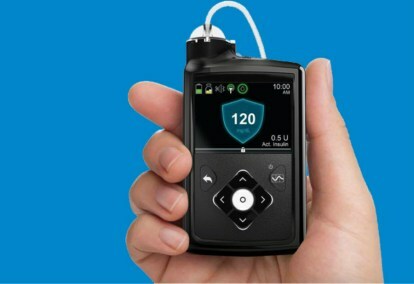
Medtronic MiniMed 670G 시스템은 지속적인 혈당 모니터링(혈당 검사)과 인슐린 펌프를 결합한 웨어러블 장치입니다. SmartGuard HCL이라고 불리는 인슐린 투여량을 조정하는 데 사용되는 알고리즘은 메드트로닉의 폐쇄 루프 시스템 단계적 개발의 마지막 단계였습니다.
추천 동영상
리처드 M. 연구 책임자이자 미니애폴리스에 있는 Park Nicollet 국제 당뇨병 센터의 전무이사인 Bergenstal, M.D. “중추적 임상시험의 데이터는 설득력이 있었고 이 치료법이 임상과 환자 모두에게 호평을 받을 것이라고 확신합니다. 지역 사회."
JDRF도 열정적입니다. “이 중요한 이정표는 제1형 당뇨병 관리에 있어 중요한 진전을 의미하며, 이 만성 질환을 앓고 있는 사람들의 삶의 질을 향상시킵니다.”라고 JDRF 회장이자 최고 경영자. “우리는 이 획기적인 기술이 FDA의 승인을 받은 속도에 매우 고무적이며, 이 흥미로운 돌파구를 달성하는 데 JDRF가 수행한 역할을 자랑스럽게 생각합니다. 메드트로닉과 JDRF는 환자가 이 치료법에 적절하게 접근할 수 있도록 최선을 다하고 있습니다.”
MiniMed 670G 시스템에는 배터리 수명이 7일인 Medtronic의 Guardian 센서 혈당 모니터가 포함되어 있습니다. Guardian은 혈당 수치를 모니터링하는 것 외에도 자가 혈당 측정 기능도 제공합니다.모니터 센서 — 환자가 센서에 의존하는 경우 고장이 나면 치명적일 수 있으므로 자가 진단이 중요합니다. 이는 폐쇄 루프 시스템에 대해 FDA가 승인한 최초이자 지금까지 유일한 센서입니다. SmartGuard HCL 알고리즘에는 혈당 수준이 최적의 목표 범위 내에 유지되도록 하기 위해 환자의 인슐린이 필요한지 학습하는 기능이 있습니다. 환자에게 필요한 유일한 조치는 식사 시간 탄수화물 섭취량을 입력하고 주기적으로 센서를 교정하는 것입니다. 더 이상 손가락 채혈, 측정, 자가 인슐린 주사가 필요하지 않습니다.
MiniMed 670G의 상업적 출시 및 가용성은 2017년 봄에 예상되며, 다른 국가의 규제 승인은 그해 여름에 예상됩니다.
편집자의 추천
- FDA, 인슐린 전달을 위한 최초의 스마트폰 앱 승인
당신의 라이프스타일을 업그레이드하세요Digital Trends는 독자들이 모든 최신 뉴스, 재미있는 제품 리뷰, 통찰력 있는 사설 및 독특한 미리보기를 통해 빠르게 변화하는 기술 세계를 계속해서 살펴볼 수 있도록 도와줍니다.


