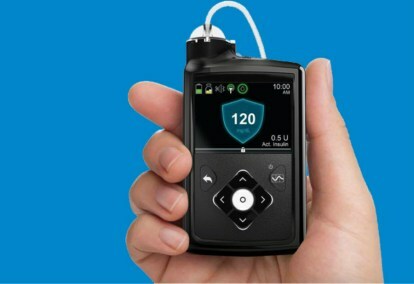
Medtronic MiniMed 670G システムは、継続的な血糖モニタリング (血糖検査) とインスリン ポンプを組み合わせたウェアラブル デバイスです。 SmartGuard HCL と呼ばれる、インスリン投与量の調整に使用されるアルゴリズムは、メドトロニックによる閉ループ システムの段階的開発の最後のステップでした。
おすすめ動画
リチャード M 氏によると、 この研究の主任研究者であり、ミネアポリスのパーク・ニコレット国際糖尿病センターのエグゼクティブディレクターであるバーゲンスタール医学博士は、 「極めて重要な試験のデータは説得力があり、この治療法は臨床医と患者の両方に受け入れられると確信しています」 コミュニティ。"
JDRFも熱心です。 「この重要なマイルストーンは、1 型糖尿病の管理における重要な前進を表しており、今後も この慢性疾患を抱えて生きる人々の生活の質を改善します」とJDRF会長のデレク・ラップ氏は語った。 最高経営責任者(CEO。 「私たちは、この画期的な技術が FDA によって迅速に承認されたことに非常に励まされており、このエキサイティングな進歩を達成する上で JDRF が果たした役割を誇りに思っています。 メドトロニックとJDRFは、患者がこの治療法に適切にアクセスできるよう努めています。」
MiniMed 670G システムには、7 日間のバッテリー寿命を持つ Medtronic の Guardian Sensor 血糖モニターが含まれています。 ガーディアンは血糖値の監視に加えて、自己監視機能も備えています。モニター センサー — 患者がセンサーに依存している場合、故障は致命的となる可能性があるため、自己診断が重要です。 これは、閉ループ システム用として FDA によって承認された最初でこれまでのところ唯一のセンサーです。 SmartGuard HCL アルゴリズムには、血糖値が最適な目標範囲内に確実に収まるように患者のインスリンが必要であることを学習する機能があります。 患者が必要とする唯一のアクションは、食事時の炭水化物摂取量を入力し、定期的にセンサーを校正することです。 何度も指を刺したり、測定したり、インスリンを自己注射したりする必要はもうありません。
MiniMed 670G の商業リリースと入手は 2017 年の春に予定されており、他の国々での規制当局の承認は同夏に行われる予定です。
編集者のおすすめ
- FDA、インスリン投与用の史上初のスマートフォンアプリを承認
ライフスタイルをアップグレードするDigital Trends は、読者が最新ニュース、楽しい製品レビュー、洞察力に富んだ社説、ユニークなスニーク ピークをすべて提供して、ペースの速いテクノロジーの世界を監視するのに役立ちます。


