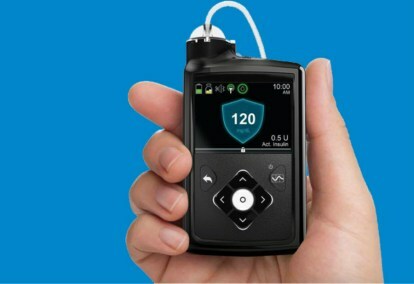
Il sistema Medtronic MiniMed 670G è un dispositivo indossabile che combina il monitoraggio continuo della glicemia (test dello zucchero nel sangue) con una pompa per insulina. L’algoritmo utilizzato per regolare il dosaggio dell’insulina, chiamato SmartGuard HCL, è stato l’ultimo passo nello sviluppo graduale del sistema a circuito chiuso da parte di Medtronic.
Video consigliati
Secondo Richard M. Bergenstal, M.D., ricercatore principale dello studio e direttore esecutivo del Park Nicollet International Diabetes Center di Minneapolis, “I dati dello studio registrativo sono stati convincenti e sono fiducioso che questa terapia sarà ben accolta sia dai clinici che dai pazienti Comunità."
Anche la JDRF è entusiasta. “Questo traguardo significativo rappresenta un importante passo avanti nella gestione del diabete di tipo 1 e lo farà migliorare la qualità della vita di coloro che vivono con questa malattia cronica”, ha affermato Derek Rapp, presidente della JDRF e AMMINISTRATORE DELEGATO. “Siamo molto incoraggiati dalla velocità con cui questa tecnologia innovativa è stata approvata dalla FDA e siamo orgogliosi del ruolo svolto da JDRF nel raggiungimento di questo entusiasmante progresso. Medtronic e JDRF si impegnano a garantire un adeguato accesso dei pazienti a questa terapia”.
Il sistema MiniMed 670G include il monitor del glucosio Guardian Sensor di Medtronic, che ha una durata della batteria di sette giorni. Oltre a monitorare i livelli di glucosio, il Guardian si auto-monitor il sensore: se i pazienti si affidano al sensore, qualsiasi guasto potrebbe essere fatale, quindi l’autodiagnosi è vitale. Questo è il primo e finora unico sensore approvato dalla FDA per i sistemi a circuito chiuso. L’algoritmo SmartGuard HCL ha la capacità di apprendere le esigenze di insulina del paziente per essere sicuri che i livelli di glucosio rimangano entro l’intervallo target ottimale. Le uniche azioni richieste dai pazienti sono inserire l'assunzione di carboidrati durante i pasti e calibrare periodicamente il sensore. Niente più polpastrelli multipli, misurazioni e iniezioni di insulina autosomministrate.
Il rilascio commerciale e la disponibilità del MiniMed 670G sono previsti nella primavera del 2017, mentre l'approvazione normativa in altri paesi è prevista per l'estate.
Raccomandazioni degli editori
- La FDA autorizza la prima app per smartphone per la somministrazione di insulina
Migliora il tuo stile di vitaDigital Trends aiuta i lettori a tenere d'occhio il frenetico mondo della tecnologia con tutte le ultime notizie, divertenti recensioni di prodotti, editoriali approfonditi e anteprime uniche nel loro genere.




