Millegi jaoks, mida nimetatakse "levinud nimi molekulaarbioloogidele”, paljud teist pole ilmselt kunagi CRISPR-ist kuulnud ega tea, miks peaksite olema põnevil (või võib-olla hirmunud). See kõik puudutab täiustatud geeniteraapiat ja splaissimist – ja see viib ulmelised ideed otse reaalsusesse. Siin on kiire KKK CRISPR-i taga oleva teaduse ja selle kohta, miks maailm nii suurt tähelepanu pöörab.
Olgu, mis on CRISPR ja mida see tähistab?
CRISPR viitab ebatavalistele DNA järjestustele, mis aitavad kaitsta organisme, tuvastades ohte – eriti viirusi – ja rünnates neid. Nimi tähistab Kobaras Regulaarselt Interspaced Lühike Palindroomne Kordub. Jah, see kõlab pisut naeruväärselt, kuid tegelikult on see DNA järjestuste endi vaadates väga täpne kirjeldus. Need on rühmitatud, eraldatud selgete intervallidega ja kui neile on määratud täheväärtused, näevad nad välja nagu lühikesed palindroomid, mis korduvad ikka ja jälle väikeste variatsioonidega.
Soovitatavad videod

CRISPR-e märgati esmakordselt juba 1980ndatel, kui teadlased uurisid arheide ja bakterite genoome. Isegi sellistes suhteliselt lihtsates genoomides hakkasid bioloogid (eriti Francisco Mojica) märkama neid veidraid järjestusi, mis näisid korduvat väga spetsiifilisel viisil, mille vahele jäid tühikud. Molekulaarbioloogid olid kindlad, et neil on ainulaadne eesmärk ja valitsevast teooriast sai peagi viirusekaitse, mis lõpuks tõestati 2007. aastal Philippe Horvathi juhtimisel. Kuid alles 2010. aastate alguses hakkasid teadlased CRISPR-i potentsiaali vastu eriti kirglikult tundma.
Seotud
- CRISPR-Cas9 geeni redigeerimine võib ühel päeval HIV-viiruse kehas "välja lülitada".
- Hiina arstid on väidetavalt ilmale toonud maailma esimesed geenitöötlusega lapsed
Nii et see on lihtsalt DNA ahel?
Jah ja ei. CRISPR-ist on saanud geenide splaissimise, redigeerimise ja üldise katsetamise võimaldaja. Selle mõistmiseks on oluline kõigepealt mõista CRISPR-ide rolli genoomides ja seda, kuidas nad toimivad organismide (tavaliselt, nagu me mainisime, bakterite) kaitsmisel. Õiglane võrdlus oleks telegraafid, mis saadavad morsekoodi. Iga jada on sõnum erineva rünnaku kohta ja iga tühik on STOP, mis selle sõnumi lõpetab. Kui metafoorid ei ole teie teema, Harvard läheb palju sügavamale.
Kui organism kohtab uut ja ohtlikku viirust, ei tea ta, kuidas end kaitsta ega viirust tagasi lüüa – ta peab õppima, nagu enamik immuunvastuseid. See võib olla keeruline, sest viirused ründavad otse DNA-d, kuid see muudab nad ka teatud viisil haavatavaks. CRISPR-järjestused varastavad viiruselt DNA võtmeahelaid ja hoiavad neid väikestes morsekoodi sõnumites. Kui sarnane viirus uuesti ründab, vastab CRISPR: "Oh, me tunnistame seda: siin on, kuidas see võita!" Ja see saadab vastava morsekoodi sõnumi lahinguväljale.
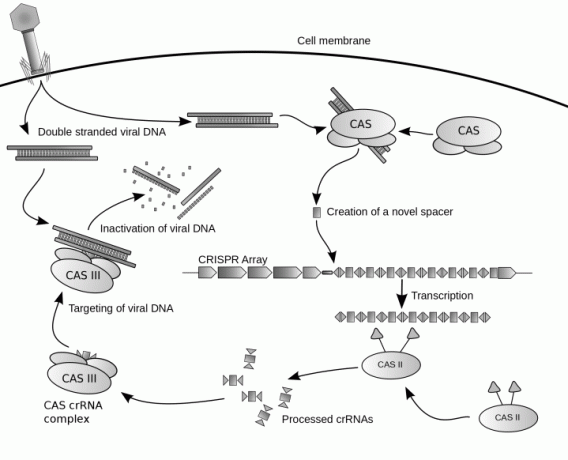
Seal kutsusid väikesed CRISPR-i sõdurid Cas – spetsiaalselt selle missiooni jaoks toodetud ja vastavalt nummerdatud ensüümid nende eesmärk – seostuda viiruse DNA-ga ja lõigata see selle nõrgast kohast, vastavalt kodeeritud teabele. sõnum. See lülitab viiruse välja ja võimaldab organismil end edukalt kaitsta.

…Okei. Miks see jälle oluline on?
Sest – ja selle tähtsust on raske alahinnata –, kuigi CRISPR kasutab ainult oma telegraafi viirustevastase kaitse süsteemi, mõistsid teadlased, et nad saavad seda telegraafi kasutada suhelda midagi. Kas geen kinni panna? Muidugi (see ei pea isegi viirusgeen olema). Kas lülitada geen sisse? Pole probleemi – lihtsalt edastage õiged juhised ensüümi Cas sõduritele. Eelkõige CRISPR-Cas9-st võib saada suurepärane tööriist DNA viilutamiseks, rekombineerimiseks ja üldiselt redigeerimiseks, kui see saab õigeid sõnumeid.
Teadlased on aastaid töötanud Cas9 juhtimise viiside kallal ja hiljem Cas9 jaoks väikeste RNA juhendite väljatöötamise nimel. sõdurid ja isegi täiendavad sõdurid kutsuvad Cpf1-ks, mis on paremad imbumisel ja väljatõmbamisel ilma selle riskita mutatsioon. Võrreldes sellega nägid vanad kohmakad geenimanipulatsiooni tööriistad välja nagu koopainimese klubid kirurgiliste laserite kõrval. Sellest sai teadusringkondades tohutu uudis ja see algatas tegelikult mitu lahingut erinevate rühmade ja teadlaste vahel selle üle, kes mille eest au väärib.

Siiamaani on kõik korras. Aga miks on see tehnoloogiamaailmas suur asi?
Sest me oleme praegu tohutu CRISPR-i katsetamise alguses. Meie meditsiiniseadmed ja teaduslikud teadmised on jõudnud punkti, kus saame rakendada kõike, mida oleme CRISPR-ist õppinud, praktikas ja alustada kiireid ja tõhusaid geenide splaissimise katseid. Neile, kes on huvitatud tipptasemel, Fringe- teaduse väärilised võtted, see on koht, kus olla.
Kas tõesti? Kas sa tahad öelda, et saame redigeerida keegiDNA nüüd?
Hea küsimus. Me ei ole veel kohal, kuid läbi on viidud mitmeid paljutõotavaid katseid. Toodeti ahvipaar spetsiifiliste geenimuutustega sihitud mutatsioonide kaudu kasutades CRISPR tehnikaid. Siin oli eesmärk tuvastada geneetilised probleemid enne sündi ja häirida vigased geenid nii, et nad ei saa mingit kahju teha (samuti oli suur asi, et see töötas ahvidega, mitte ainult ahvidega hiired). Teised katsed on näidanud, et seda protsessi saab ka kasutada DNA-d ohutult muuta, et HIV-nakkusele vastu seista.
Kõige põnevam eksperiment on aga käimas Hiinas, kus teadlased üritavad kasutada CRISPR-i tehnikaid eemaldada kahjustatud DNA rakkudest elavate täiskasvanud kopsuvähiga patsientide seas. Sellel projektil on palju silmi, et näha, kui edukas see on.
Olgu: milline näeb CRISPR-i tulevik välja?
Meil on palju tööd teha. Väärib märkimist, et ülalmainitud katsed nõudsid pikka aega kulukat uurimistööd ja palju-palju ebaõnnestunud juhtumeid edu saavutati – ja isegi siis nõuab nende katsete täpse kordamise õppimine tõsist tööd ja investeeringuid.
Kuid see puudutab rohkem viimistlemist kui uusi avastusi: Teisisõnu, on vaid aja küsimus, enne kui õpime CRISPR-i piisavalt hästi kasutama, et rakendusi meditsiinimaailma tuua. Kui see hakkab juhtuma (ja see võib olla vaid mitme aasta pärast), on paljud geenimanipulatsiooniga seotud teoreetilised küsimused, disaineri beebid, relvastatud organismid, inimese võimendus ja ravi eest tasulised süsteemid muutuvad palju enamaks kui teoreetiliseks.
Toimetajate soovitused
- CRISPR-i geenide redigeerimine võib aidata peatada levinud kodulindude viiruse jälgedes
- CRISPR-i beebisaaga jätkub, kuna Hiina kinnitab teist geeniga muudetud rasedust
- CRISPR-i geenide redigeerimine loob kokaiinikindlaid hiiri, mille eesmärk on lahendada sõltuvusmõistatus


