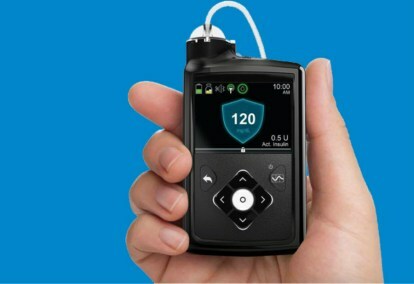
Das Medtronic MiniMed 670G-System ist ein tragbares Gerät, das eine kontinuierliche Blutzuckerüberwachung – Blutzuckermessung – mit einer Insulinpumpe kombiniert. Der zur Anpassung der Insulindosierung verwendete Algorithmus namens SmartGuard HCL war der letzte Schritt in der schrittweisen Entwicklung des Closed-Loop-Systems durch Medtronic.
Empfohlene Videos
Laut Richard M. Bergenstal, M.D., Hauptforscher der Studie und Geschäftsführer des Park Nicollet International Diabetes Center in Minneapolis, „Die Daten aus der Zulassungsstudie waren überzeugend und ich bin zuversichtlich, dass diese Therapie sowohl vom Klinikpersonal als auch vom Patienten gut angenommen wird Gemeinschaft."
Auch die JDRF ist begeistert. „Dieser bedeutende Meilenstein stellt einen wichtigen Schritt vorwärts bei der Behandlung von Typ-1-Diabetes dar und wird dazu beitragen „Verbessern Sie die Lebensqualität derjenigen, die mit dieser chronischen Krankheit leben“, sagte Derek Rapp, JDRF-Präsident und CEO. „Wir sind sehr ermutigt über die Geschwindigkeit, mit der diese bahnbrechende Technologie von der FDA zugelassen wurde, und wir sind stolz auf die Rolle, die JDRF bei diesem aufregenden Durchbruch gespielt hat.“ Medtronic und JDRF setzen sich dafür ein, dass Patienten einen angemessenen Zugang zu dieser Therapie erhalten.“
Das MiniMed 670G-System umfasst den Guardian Sensor-Glukosemonitor von Medtronic, der eine Batterielebensdauer von sieben Tagen hat. Zusätzlich zur Überwachung des Glukosespiegels überwacht der Guardian auch selbstMonitore der Sensor – wenn sich Patienten auf den Sensor verlassen, kann jeder Ausfall tödlich sein, daher ist eine Selbstdiagnose unerlässlich. Dies ist der erste und bisher einzige von der FDA für Closed-Loop-Systeme zugelassene Sensor. Der SmartGuard HCL-Algorithmus ist in der Lage, den Insulinbedarf des Patienten zu ermitteln, um sicherzustellen, dass der Blutzuckerspiegel im optimalen Zielbereich bleibt. Die einzigen vom Patienten erforderlichen Maßnahmen bestehen darin, die Kohlenhydrataufnahme während der Mahlzeiten einzugeben und den Sensor regelmäßig zu kalibrieren. Keine mehrfachen Fingerstiche, Messungen und selbst verabreichten Insulinspritzen mehr.
Die kommerzielle Markteinführung und Verfügbarkeit des MiniMed 670G wird im Frühjahr 2017 erwartet und die behördliche Zulassung in anderen Ländern wird im Sommer erwartet.
Empfehlungen der Redaktion
- Die FDA genehmigt die erste Smartphone-App für die Insulinabgabe
Werten Sie Ihren Lebensstil aufDigital Trends hilft Lesern mit den neuesten Nachrichten, unterhaltsamen Produktrezensionen, aufschlussreichen Leitartikeln und einzigartigen Einblicken, den Überblick über die schnelllebige Welt der Technik zu behalten.